近日,我校龚其海教授团队在国际顶级期刊《Advanced Science》 (IF=14.1,中科院1区TOP期刊)在线发表了题为“Asingle-moleculepleuripotentscaffold forcombinationaltherapy of Alzheimer’sdisease viaintranasaladministration”的高水平研究论文。论文第一作者为高健美教授,通讯作者为龚其海教授,共同第一作者为南开大学李文博博士和贵州大学陈娜娜博士,共同通讯作者为南开大学郭东升教授,我校为第一完成单位。
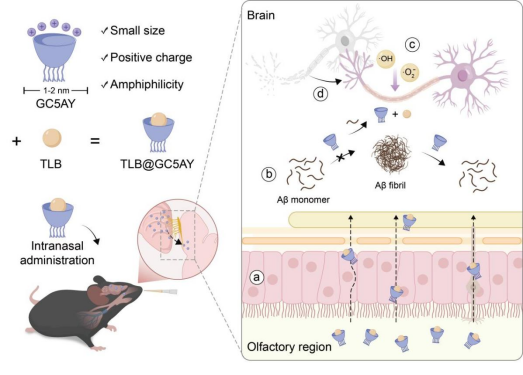
阿尔茨海默病(AD)是一种复杂的神经退行性疾病,其病理学特征为β-淀粉样蛋白(Aβ)沉积、tau蛋白过度磷酸化和神经原纤维缠结。目前临床仍缺乏有效治疗手段,现有药物多限于缓解症状,且存在毒性较大、价格昂贵等局限。鉴于该疾病的多因素发病机制,多靶点联合治疗已成为重要研究方向,但常规给药受血脑屏障(BBB)限制难以起效。鼻内递药利用嗅神经和三叉神经通路绕过BBB,为中枢递送提供了新途径。
该研究通过药学、材料与生物医学的深度交叉,设计并合成了一种胍基修饰杯芳烃(GC5AY),可作为AD联合治疗的单分子鼻内给药载体。凭借其大环主体的固有包合特性,GC5AY能够高效负载药物并经鼻向中枢递送。更重要的是,GC5AY可与Aβ结合并有效抑制其聚集、促进成熟纤维解聚,还凭借杯芳烃骨架固有的抗氧化性能清除ROS,缓解AD脑内氧化应激和神经炎症。为进一步增强多靶点协同治疗效应,该研究选用具有抗Aβ沉积、抗氧化和抗炎活性的神经保护剂三叶苷(TLB)作为模型药物,将其装载至GC5AY空腔中,构建了TLB@GC5AY制剂。该制剂不仅继承了GC5AY所介导的高效鼻脑递送能力,还整合了对Aβ病理、氧化应激和炎症等多个病理环节的联合干预。体内实验表明,TLB@GC5AY可显著改善AD模型小鼠的认知功能,并有效减轻Aβ沉积、氧化应激、神经炎症、线粒体损伤及神经元凋亡。该研究成功发展了一种基于超分子载体的鼻内递送策略,为实现AD的多靶点联合治疗提供了新思路,对推动神经退行性疾病治疗的临床转化具有重要潜力。
该研究获得国家自然科学基金、贵州省中央引导地方科技发展专项资金、贵州省高层次创新型人才“百层次”人才项目的资助。(信息来源:基础药理教育部重点实验室;审核|一审:李晓,二审:上官腾飞,三审:杨清玉)
论文链接:http://doi.org/10.1002/advs.202511611


