近日,我校第二附属医院马虎教授团队在期刊《MedComm》(IF=10.7,中科院和JCR双一区,TOP期刊)上发表了一篇题为“Human Endogenous Retroviruses and Diseases”的综述论文。肿瘤学硕士研究生陈灿为该论文第一作者,马虎教授、周建国副主任医师为该论文共同通讯作者,遵义医科大学第二附属医院(贵州省肿瘤防治全省重点实验室)为第一完成单位。

HERVs是古代逆转录病毒感染生殖细胞后整合到人类基因组的遗迹,占人类基因组的近8%,曾被视为无功能的 “基因组化石”。最新研究证实,这些元件通过表观遗传调控、分子模拟等机制,在生理调节和疾病发生中发挥双重作用。其结构中的长末端重复序列(LTRs)可作为启动子或增强子调控邻近基因表达,部分年轻亚家族(如HERVK、HERVW)仍保留完整开放阅读框,能在特定条件下产生功能蛋白和类病毒颗粒。在癌症中,HERVs异常激活可通过激活癌信号通路、诱发基因组不稳定性、调控肿瘤免疫微环境等促进肿瘤发生发展,同时其衍生抗原可作为肿瘤特异性靶点;在多发性硬化症、系统性红斑狼疮等自身免疫性疾病中,HERVs核酸和蛋白可激活先天免疫通路,引发异常炎症反应;在肌萎缩侧索硬化症、阿尔茨海默病等神经退行性疾病中,HERVs再激活与蛋白聚集、神经元损伤密切相关。该研究梳理了当前HERVs靶向治疗的前沿策略,包括表观遗传调节剂、单克隆抗体、CAR-T细胞疗法、基因编辑等,并梳理了多项正在开展的临床研究进展。例如,针对HERVW包膜蛋白的单克隆抗体在多发性硬化症临床试验中显示出神经保护潜力,逆转录酶抑制剂在遗传性自身炎症综合征治疗中已取得初步疗效,为疾病治疗提供了新的临床方向。
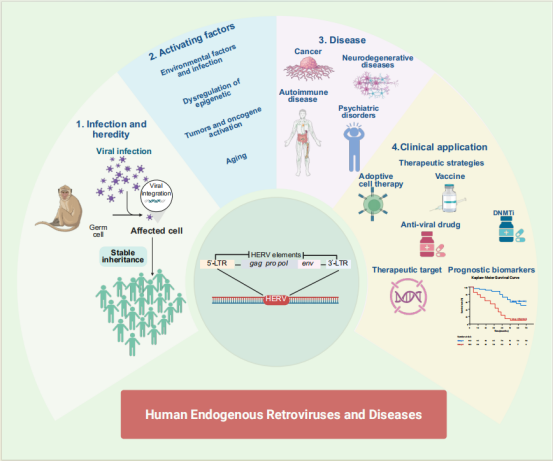
HERVs作为基因组中独特的调控元件,其在疾病中的作用被重新认识,为精准医学开辟了新赛道。未来需进一步突破检测技术标准化、靶向特异性等瓶颈,通过多学科交叉融合推动相关疗法的临床转化。该研究得到国家自然科学基金青年a金C类、四大慢病国家科技重大专项等项目支持。(审核|一审:李晓,二审:上官腾飞,三审:杨清玉,图文:第二附属医院)
论文链接: http://dx.doi.org/10.1002/mco2.70452


